Istraživanja o raznim supstancama su pokazala. Interakcije čestica
Na slici desno, čestice tijela su shematski predstavljene uredno raspoređenim kuglicama. Strelice pokazuju sile odbijanja koje deluju na česticu od njenih „suseda“. Kada bi sve čestice bile na jednakoj udaljenosti jedna od druge, tada bi odbojne sile bile međusobno uravnotežene („zelena“ čestica).
Međutim, prema drugoj poziciji MCT-a, čestice se neprestano i nasumično kreću. Zbog toga se udaljenosti od svake čestice do njenih susjeda stalno mijenjaju („crvena“ čestica). Posljedično, sile njihove interakcije se stalno mijenjaju i nisu uravnotežene, težeći vraćanju čestice u ravnotežni položaj. to je, potencijalna energijačestice čvrstih i tečnih tela, koje uvek postoje, neprestano se menjaju. Uporedite: u gasovima praktično nema potencijalne energije čestica, pošto su one udaljene jedna od druge (vidi § 7-b).
Pojava elastične sile. Stiskanjem ili istezanjem, savijanjem ili uvrtanjem tijela približavamo njegove čestice ili ih uklanjamo (vidi sliku). Zbog toga se mijenjaju sile privlačenja i odbijanja čestica, čije je zajedničko djelovanje elastična sila.
Uobičajeno smo prikazali gumene čestice gumice koja se može savijati (vidi i sl. “d”) kao kuglice. Prilikom pritiska prstom, gornje čestice se približavaju jedna drugoj („zelena“ udaljenost je manja od „crvena“). To dovodi do pojave odbojnih sila (crne strelice su usmjerene dalje od čestica). U blizini donje ivice gumice čestice se udaljavaju jedna od druge, što dovodi do pojave privlačnih sila između njih (crne strelice su usmjerene prema česticama). Kao rezultat istovremenog djelovanja odbojnih sila blizu gornje ivice i privlačnih sila blizu donje ivice, gumica "želi" da se ispravi. A to znači da u njemu nastaje elastična sila, usmjerena suprotno od sile pritiska.
Testirajte svoje znanje:
- Glavna svrha ovog paragrafa je da diskutuje...
- Šta ćemo primijetiti kada se krajevi cilindara stisnu?
- Da li cilindri čvrsto prianjaju jedan za drugi?
- Kakav zaključak slijedi iz eksperimenta s cilindrima?
- Pod kojim uslovima dolazi do privlačenja čestica tela i supstanci?
- Koje opažanje ukazuje na odbijanje čestica?
- Zašto mislimo da se čestice supstanci mogu međusobno odbijati?
- Pod kojim uslovima se opaža interakcija čestica?
- Kako se priroda interakcije između čestica materije mijenja ovisno o udaljenosti između njih?
- U kom slučaju nema interakcije između čestica supstanci?
- Zašto čestice tvari mogu imati potencijalnu energiju?
- Zašto čestice čvrstih i tečnih materija uvek imaju potencijalnu energiju?
- Šta simboliziraju crne strelice na slici sa čvrstim česticama?
- Budući da se čestice bilo kojeg tijela ili tvari neprestano kreću,...
- Budući da se udaljenosti između čestica stalno mijenjaju,...
- Opišite potencijalnu energiju čestica čvrstih tijela i tekućina. Ona, ...
- Opišite potencijalnu energiju čestica plina.
- U kojim slučajevima mijenjamo rastojanje između čestica tijela?
- Istovremeno se mijenjaju sile privlačenja i odbijanja tjelesnih čestica, jer...
- Sila elastičnosti tijela je istovremeno djelujući...
- Šta se dešava sa česticama blizu vrha gumice? Oni...
- Elastična sila u gumici nastaje zbog...
Molekularno-kinetičke ideje o strukturi materije objašnjavaju raznolikost svojstava tečnosti, gasova i čvrstih materija. Postoje elektromagnetne interakcije između čestica materije - one privlače i odbijaju jedna drugu pomoću elektromagnetnih sila. Na vrlo velikim udaljenostima između molekula ove sile su zanemarljive.
Molekularne interakcijske sile
Ali slika se mijenja ako se razmak između čestica smanji. Neutralne molekule počinju se orijentirati u prostoru tako da njihove površine okrenute jedna prema drugoj počinju imati naboje suprotnog predznaka i među njima počinju djelovati privlačne sile. To se događa kada je udaljenost između centara molekula više od iznosa njihovi radijusi.
Ako nastavite smanjivati udaljenost između molekula, oni se počinju odbijati kao rezultat interakcije slično nabijenih elektronskih ljuski. To se događa kada je zbir polumjera molekula koji djeluju u interakciji veći od udaljenosti između centara čestica.
Odnosno, na velikim međumolekularnim udaljenostima prevladava privlačnost, a na bliskim odbijanje. Ali postoji određena udaljenost između čestica kada su u stabilnom ravnotežnom položaju (privlačne sile su jednake silama odbijanja). U ovom položaju molekuli imaju minimalnu potencijalnu energiju. Molekuli također imaju kinetičku energiju, jer su stalno u pokretu.
Dakle, jačina interakcijskih veza između čestica razlikuje tri stanja materije: čvrsto, gasovito i tečno, i objašnjava njihova svojstva.
Uzmimo vodu kao primjer. Veličina, oblik i hemijski sastavčestice vode ostaju iste bilo da je čvrsta (led) ili gasovita (para). Ali način na koji se te čestice kreću i pozicioniraju je različit za svako stanje.
Čvrste materije
 Čvrste tvari zadržavaju svoju strukturu i mogu se popucati ili slomiti silom. Ne možete proći kroz sto jer ste i vi i stol čvrsti. Čvrste čestice imaju najmanju količinu energije od tri tradicionalna stanja materije. Čestice su raspoređene u specifičnom strukturnom nizu sa vrlo malim razmakom između njih.
Čvrste tvari zadržavaju svoju strukturu i mogu se popucati ili slomiti silom. Ne možete proći kroz sto jer ste i vi i stol čvrsti. Čvrste čestice imaju najmanju količinu energije od tri tradicionalna stanja materije. Čestice su raspoređene u specifičnom strukturnom nizu sa vrlo malim razmakom između njih.
Oni se drže zajedno u ravnoteži i mogu samo vibrirati oko fiksne pozicije. U tom smislu, čvrste materije imaju visoke gustine I fiksnog oblika i zapremine. Ako ostavite sto na miru nekoliko dana, on se neće proširiti i tanak sloj drveta po cijelom podu neće ispuniti prostoriju!
Tečnosti
 Baš kao iu čvrstoj materiji, čestice u tečnosti su zbijene jedna blizu druge, ali raspoređene nasumično. Za razliku od čvrstih tijela, osoba može proći kroz tekućinu, to je zbog slabljenja sile privlačenja koja djeluje između čestica. U tečnosti, čestice se mogu kretati jedna u odnosu na drugu.
Baš kao iu čvrstoj materiji, čestice u tečnosti su zbijene jedna blizu druge, ali raspoređene nasumično. Za razliku od čvrstih tijela, osoba može proći kroz tekućinu, to je zbog slabljenja sile privlačenja koja djeluje između čestica. U tečnosti, čestice se mogu kretati jedna u odnosu na drugu.
Tečnosti imaju fiksni volumen, ali nemaju fiksni oblik. Oni će tok pod uticajem gravitacionih sila. Ali neke tečnosti su viskoznije od drugih. Viskozna tečnost ima jače interakcije između molekula.
Molekuli tečnosti imaju mnogo više kinetičke energije (energije kretanja) od čvrstih, ali mnogo manje od gasa.
Gasovi
 Čestice u gasovima su udaljene jedna od druge i nasumično raspoređene. Ovo stanje materije ima najviše kinetička energija, pošto praktički ne postoje privlačne sile između čestica.
Čestice u gasovima su udaljene jedna od druge i nasumično raspoređene. Ovo stanje materije ima najviše kinetička energija, pošto praktički ne postoje privlačne sile između čestica.
Molekule plina su u stalnom kretanju u svim smjerovima (ali samo pravolinijski), sudaraju se jedna s drugom i sa zidovima posude u kojoj se nalaze - to uzrokuje pritisak.
Plinovi se također šire kako bi u potpunosti ispunili zapreminu posude, bez obzira na njenu veličinu ili oblik - gasovi nemaju fiksni oblik ili zapreminu.
čestica atom elementarni kvark
Najvažnije pitanje u fizici je pitanje interakcija. Da nije bilo interakcija, čestice materije bi se kretale nezavisno, nesvesne postojanja drugih čestica. Zahvaljujući interakcijama, čestice stiču sposobnost prepoznavanja drugih čestica i odgovora na njih, što dovodi do kolektivnog ponašanja. Jer sve materija se sastoji od čestica, da bi se objasnila priroda sila potrebno je, u krajnjoj liniji, okrenuti se fizici elementarnih čestica. Učinivši to, fizičari su otkrili da se sve interakcije, bez obzira na to kako se manifestiraju na velikim skalama, mogu svesti na četiri osnovna tipa: gravitacionu, elektromagnetnu i dva nuklearna tipa.
Na nivou kvarka oni dominiraju nuklearne interakcije. Jaka interakcija povezuje kvarkovi u protone i neutrone i sprečavaju jezgre da se raspadnu. Na atomskom nivou prevladava elektromagnetna interakcija, povezujući atome i molekule. U astronomskoj skali postaje dominantan gravitaciona interakcija.
IN poslednjih godina fizičari su se zainteresovali za odnos između četiri fundamentalne sile koje zajedno upravljaju Univerzumom. Ima li veze između njih? Nisu li to samo različite hipostaze jedinog temeljnog supermoći? Ako takva supermoć postoji, onda je upravo ona ona koja predstavlja aktivni princip svih aktivnosti u Univerzumu – od rođenja subatomskih čestica do kolapsa zvijezda. Razotkrivanje misterije supermoći bi nezamislivo povećalo našu moć nad prirodom, pa čak i objasnilo samo „kreiranje“ svijeta.
Već znamo da elementarne čestice međusobno komuniciraju preko drugih čestica koje kontinuirano emituju i apsorbuju. Slojevi ovih čestica se ekraniziraju, tako da čestica izgleda drugačije nabijena s različitih visina. Upravo tako vide jedna drugu čestice koje se sudaraju, uvijek različito nabijene. Što je njihova energija veća, to dublje prodiru jedni u druge i jasnije osjećaju "dah" svojih centralnih nezaštićenih naboja. Stoga to možemo očekivati sa povećanjem energije razne vrste interakcije će postajati sve sličnije i sa visoke energije spojit će se u jednu jedinu interakciju - supersilu. Doći će do “velikog ujedinjenja” svih prirodnih sila.
Prava situacija je nešto komplikovanija. Zaštitni oblaci se formiraju ne samo oko naboja, već i oko svake čestice nosača, s kojima se sudarajuće čestice međusobno ispituju. Ako su nosioci interakcije veoma teški, onda se interakcija prenosi na ultra-kratke udaljenosti. Daleko od centra, takve čestice se gotovo nikada ne nalaze i interakcija povezana s njima je vrlo slaba. U drugim slučajevima, nosioci su lagani (na primjer, fotoni), mogu se kretati daleko od naboja koji ih emituje, a uz njihovu pomoć dolazi do interakcije na velikim udaljenostima.
Dakle, ne samo čestice, već i sile koje ih vezuju ispadaju izuzetno složene. Ne možete ih nazvati ni najjednostavnijim tačkama! I teško je povjerovati da je gravitacijska sila dva elektrona u milijardama velika snaga njihovo elektromagnetno odbijanje - grane istog drveta.
Fizičari su na ideju „velikog ujedinjenja“ došli sasvim nedavno - prije dvadesetak do trideset godina, iako su prvi korak učinili Faraday i Maxwell, koji su spojili elektricitet i magnetizam, koji su tada smatrani potpuno različite interakcije. Takođe su uveli koncept „polja“. Faraday je dokazao da su elektricitet i magnetizam dvije komponente istog elektromagnetnog polja.
Sljedeći korak na putu “velikog ujedinjenja” bio je mnogo teži. Napravljen je tek sredinom 60-ih godina dvadesetog veka. Pažnju fizičara tada je privukla slaba interakcija. Imao je jednu čudnu osobinu: za sve ostale sile može se odrediti međupolje, čiji kvanti služe kao nosioci interakcije, a u procesima raspada čestice „razgovaraju“, da tako kažem, direktno, bez ikakvih posrednika, gurajući svaku druge poput loptica za bilijar.
Prirodno je pretpostaviti da i u ovom slučaju dolazi do razmjene između čestica, ali samo toliko teške da se cijeli proces odvija na vrlo malim udaljenostima, a spolja izgleda kao da se čestice jednostavno guraju jedna drugu.
Proračuni su pokazali da da nije velike mase međučestica, onda bi takva interakcija po svojstvima bila vrlo slična elektromagnetnim. Tako su trojica fizičara: Abdus Salam, Steve Weinberg i Sheldon Glashow priznali da su foton i teške međučestice slabe interakcije ista čestica, samo u različitim “kaputima”. Teoriju koju su razvili počeli su nazivati "elektroslabom", jer je, kao poseban slučaj, sadrži elektrodinamiku i staru teoriju slabih interakcija. Ubrzo su teški kvanti elektroslakog polja uhvaćeni na akceleratorima - tri bratska mezona čija je masa skoro stotinu puta veća od mase protona. Stvaranje teorije elektroslabog polja i eksperimentalno otkriće njegovih nosilaca nagrađeni su dvije Nobelove nagrade.
Inspirirani otkrićem elektroslabog polja, fizičari su se zainteresirali za novu ideju daljeg ujedinjenja - spajanje snažne interakcije s elektroslakim. Suština ove ideje je sljedeća. Svaki kvark ima analog električni naboj, zove se boja. Za razliku od naboja, kvark ima tri vrste boja. Stoga je polje gluona složenije. Sastoji se od osam komponentnih polja sile. U tipičnom hadronu - protonu ili neutronu - kombinacija tri kvarka - crvenog, zelenog i plavog - uvijek je "bijele" boje. Emitovani mezoni sadrže parove kvark-antikvark, tako da su i oni "bezbojni". S obzirom da znamo da se tokom interakcija čestica, njihovi naboji zaklanjaju, to dovodi do efekata razlika u opsegu interakcija razne vrstečestice. Procjena udaljenosti na kojoj sve interakcije postaju uporedive po veličini je oko 10 do -29 centimetara. Nosač interakcije, X čestica, ima masu jednaku približno 10 do 14. stepena mase protona. Tokom malog vremenskog perioda u kojem X čestica postoji, energija i masa imaju ogromnu nesigurnost. I u tom pogledu smo slični Talesu i drugim grčkim filozofima, koji su razmišljali o svojstvima atoma, bez imalo nade da će ih ikada vidjeti.
Elementarne čestice se ne mogu podijeliti na jednostavnije dijelove (zato su i nazvane „elementarnim“). U svim reakcijama koje su danas poznate, te se čestice samo pretvaraju jedna u drugu – međusobno se pretvaraju. Štoviše, teže čestice se mogu roditi iz pluća - ako se kreću dovoljnom brzinom (kinematička energija se pretvara u masu)
Elementarne čestice se razlikuju po naboju, spinu, masi, životnom vijeku itd. Na primjer, životni vijek protona je duži od vijeka trajanja svemira, a ro mezon živi 10 do -23 sekunde. Masa fotona i neutrina je nula, a masa još neotkrivenog, ali predvidjenog od strane teoretičara maksimona (najteže elementarne čestice koja može postojati) je nešto oko mikrograma - poput velike mrlje prašine vidljive oku. Mogu se podijeliti u porodice, a članovi svake se mogu smatrati različitim stanjima iste čestice. Porodice se udružuju u složenije grupe - klanove ili multiple. Ali glavna stvar je da su multipleti povezani određena pravila simetrija. Sveukupno izgleda otprilike periodni sistem elementarne čestice, poput Mendeljejeva. Može se pretpostaviti da su fizičari pronašli sljedeći nivo strukture materije.
Akceleratori čestica igrali su veliku ulogu u razvoju znanja. Elektronsko skeniranje je pokazalo da proton zapravo nije tačka, već pre veliki objekat sa radijusom od oko 10 do -13 centimetara. Analizirajući rezultate novih eksperimenata o rasejanju elektrona, naučnici su zaključili da su nukleoni roj nekih veoma malih čestica, koje pri manjem uvećanju izgledaju kao gomila mezona i drugih elementarnih čestica koje se preklapaju i prodiru jedna u drugu. Teoretičari koji su se bavili klasifikacijom čestica bili su oduševljeni, pošto su dugo sumnjali u postojanje takvih čestica, samo su ih nazvali na svoj način: kvarkovi.
Kada su se kvarkovi pojavili na stranicama teorijskih radova, mnogi naučnici su ih smatrali samo nekom vrstom radoznalosti, privremenom skelom na putu ka savršenijoj teoriji. Međutim, prije nego što su fizičari imali vremena da se osvrnu, ispostavilo se da se uz pomoć kvarkova može vrlo jednostavno i jasno objasniti širok spektar eksperimentalnih činjenica, a teorijski proračuni su uvelike pojednostavljeni. Postalo je jednostavno nemoguće bez kvarkova, baš kao i bez molekula i atoma.
Eksperimenti nukleonskog sondiranja dokazali su da u središtu elementarne čestice kvarkovi gotovo da nisu vezani interakcijom i ponašaju se kao da lebde u zraku baloni. Ako se pokušaju raspršiti, odmah se javljaju sile koje ih vuku zajedno. Na periferiji, kvarkovi mogu biti samo u obliku vezanih nakupina – na primjer, u obliku pi-mezona, što je u skladu s teorijom nuklearne interakcije zasnovanoj na mezonima. Ali kako kvarkovi međusobno djeluju? Budući da nauka ne poznaje drugi način da organizuje interakciju osim putem prenosa čestice-nosača interakcije, predloženi su gluoni - čestice koje spajaju kvarkove. Gluoni su slični fotonima, samo sa nabojem. Foton ne stvara nikakvo polje oko sebe, stoga polje ima najveći intenzitet u blizini svog izvora - naboja, zatim se postepeno raspršuje i slabi. Gluon svojim nabojem rađa nove gluone, koji zauzvrat rađaju sljedeće, i tako dalje, tako da polje gluona ne slabi, već se, naprotiv, povećava s udaljenosti od kvarka koji ga je stvorio. . Opadajući kvark, poput pjene, zarasta novim gluonima i njihova veza postaje jača.
Fizika čestica je nevjerovatna fuzija eksperimenta i teorije. Svojstva najmanjih čestica materije su utvrđena i nastavljaju da se utvrđuju u eksperimentima čija je složenost neuporediva u drugim oblastima nauke. Ovi jedinstveni eksperimenti kombinuju istinski industrijski razmjer s preciznošću nakita. U većini slučajeva, sami objekti istraživanja - čestice - nastaju upravo tu u laboratoriji uz pomoć akceleratora i žive tako beznačajne vremenske periode da se u poređenju s njima trenutak čini kao vječnost. Među milijardama sličnih „neinteresantnih“ raspada mora se pronaći slučaj nekog retkog raspada čestice. Sve informacije o elementarne čestice dobijene pažljivim merenjima.
With. 1
§ 6. Koja su svojstva najmanjih čestica materije?
Studija različite supstance pokazao da postoje praznine između atoma i molekula u materiji, U to se uvjerite kada popijete čaj sa šećerom. Ako pažljivo sipate granulirani šećer u punu čašu toplog čaja, čaj neće proliti iz čaše. To je moguće samo zato što su molekule saharoze zauzele prostor između molekula vode, kao što će grašak, bez prelivanja, zauzeti prostor između krompira ako želimo da u kantu krompira dodamo par čaša graška. Razmaci između molekula su uporedivi sa veličinama samih molekula, tj. veoma mali. Sljedeći eksperimenti će vam pomoći da potvrdite postojanje ovih međumolekularnih praznina.
Stisnite balon ispunjen vazduhom. To možete učiniti lako, jer se međumolekularne praznine smanjuju. Molekuli zraka se ne mijenjaju, već se samo približavaju.
Sada uzmimo tikvicu koja sadrži zrak, zatvorimo je čepom s umetnutom cijevi u kojoj se nalazi kap obojene tekućine. Kada se boca zagreje, kap tečnosti će se podići kroz cev. To se događa jer kada se zrak zagrije, razmaci između molekula se povećavaju, što znači da se volumen plina povećava i pomiče kapljicu prema gore.
Ovaj fenomen se uzima u obzir prilikom izgradnje željeznice kada ostavljaju praznine na šinama. Ljeti se šine zagrijavaju i šire. Stoga, da nema praznina, šine bi mogle puknuti ili se saviti, što bi dovelo do željezničkih nesreća. (Često ste promatrali kako mlijeko curi iz tiganja ili vruće vode iz kotla napunjenog do vrha. Ovo su također primjeri koji dokazuju da postoje praznine između molekula i atoma u tvari.
Čestice materije (atomi i molekuli) kreću se neprekidno, nasumično.
U to nas uvjerava svakodnevno iskustvo. Bez napuštanja sobe, znamo šta mama sprema za večeru. Miris pite ili kafe lako se širi po stanu. Ako otvorimo bočicu parfema, vrlo brzo će se njegov miris proširiti po prostoriji. Jorgovan je procvjetao, a njegova divna aroma se osjeća po cijeloj bašti.
Kako objasniti širenje mirisa?
Ispostavilo se da se molekuli tvari kreću. Istovremeno se sudaraju s molekulima zraka, krećući se nasumično, šire se u određenom prostoru i miješaju se s molekulima plinova i zraka. Opaženi fenomen se naziva difuzija .
dakle,difuzija je međusobno prodiranje dodirujućih supstanci jedna u drugu, nastalo zbog slučajnog kretanja čestica tvari.
Difuzija je jedan od osnovni dokaz kontinuiranog, nasumičnog kretanja čestica materije (atoma i molekula).
Tokom difuzije, čestice jedne supstance imaju tendenciju da se ravnomerno rasporede između čestica druge supstance.
Difuzija se javlja u bilo kojem tijelu, ali različitom brzinom. Posmatrajući ovaj fenomen, naučnici su otkrili da brzina kretanja molekula zavisi od temperature. Što je temperatura viša, dolazi do brže difuzije, što znači da se molekuli brže kreću. Pa ipak, miris ne osjećamo odmah, već nakon nekoliko minuta, jer se molekuli plina sudaraju s drugim molekulima i kreću se po vrlo složenoj liniji.
U tečnostima je brzina kretanja molekula manja nego u gasovima. Ako ne promiješamo čaj, za dva dana će postati sladak. Biće potrebne godine da dođe do difuzije u čvrstim materijama. Na primjer, primjećeno je da je u starim zgradama često nemoguće razdvojiti vijke koji drže dijelove zajedno, jer oni „srastu“ jedan s drugim.
Zanimljiva činjenica. Molekuli tvari su vrlo mali, pa je nemoguće vidjeti njihovo kretanje čak ni pod mikroskopom. Ali možete vidjeti kako molekuli tekućine "guraju" veće čestice ako uzmete u obzir kap kontaminirane vode. Ovu pojavu prvi je uočio engleski botaničar Robert Brown 1827. Ispitivao je polen pomešan u vodi kroz mikroskop.
Tamne čestice jurile su napred-nazad u vidnom polju uređaja. Veliki su se kretali polako, mali su skakali brzo i nasumično.
Braun je bio pravi naučnik i, suočen sa neshvatljivim fenomenom, savesno ga je istraživao. Uvjerio se da je putanja ovih čestica nasumična i otkrio da je u tople vode kreću se brže nego po hladnom vremenu.
Ali Braun je bio botaničar, i da objasni šta je video fizički fenomen nije mogao. U tome je uspio samo A. Einstein 1905. godine. haotično kretanječestica materije naziva se Brownovo kretanje čestica.
Koja je uloga difuzije u živoj prirodi?
Difuzija ima velika vrijednost u životu ljudi, životinja i biljaka. Zahvaljujući difuziji, u plućima i tkivima živih organizama dolazi do izmjene plinova, odnosno procesa disanja. Kada izdahnete, uklanja se ugljični dioksid, a kada udišete, kiseonik ulazi sa vazduhom, koji iz pluća difuzijom ulazi u krv. Proces ishrane u svim organizmima ne može se odvijati bez difuzije. Čestice hranljive materije apsorbiraju se crijevnim mikroresicama i ulaze u krv kroz kapilare (sićušne žile). U životu nekih živih organizama od velike je važnosti disanje kroz kožu, koje se opet javlja zbog difuzije.
Široko se koristi u vrtlarstvu folijarno prihranjivanje biljke prskanjem njihove krošnje. U ovom slučaju, difuzija - prodiranje hranjivih tvari u biljku događa se kroz lišće i brže nego kroz korijenski sistem. Zahvaljujući difuziji, dolazi i do ishrane biljaka čiji korijenski sistem upija tvari koje se nalaze u tlu.
Zbog difuzije iz zraka kisik se dovodi u vodu prirodnih rezervoara i akvarija, što je od vitalnog značaja za njihove stanovnike.
U materiji postoje razmaci između atoma i molekula. Čestice materije su u neprekidnom, nasumičnom kretanju, što je dokaz difuzije.
Difuzija se javlja u bilo kojem tijelu (gasovitom, tekućem i čvrstom), ali različitom brzinom, koja raste s porastom temperature, a opada sa padom temperature.
Difuzija je od velike važnosti u životu svakog živog organizma.
Difuzija
Testirajte svoje znanje
1. Koja svojstva imaju najmanje čestice materije?
2. Dokazati postojanje praznina između sitne čestice supstance.
3. Zašto je izlivanje nafte na površini rezervoara opasno?
4. Šta se naziva difuzija?
5. U kojim tijelima se javlja difuzija i od čega zavisi njena brzina?
6. Recite nam o važnosti difuzije u prirodi i životu organizama.
§ 7. Kako čestice materije međusobno deluju?
Pokušajte rastegnuti komad drveta ili kamena. Malo je vjerovatno da ćete uspjeti. Zašto? Zato što čestice materije međusobno djeluju. U ovom slučaju su veoma su privučeni. Prilikom cijepanja lista papira ili cijepanja trupca primjenjujemo određenu silu, jer odvajamo mnoge čestice tvari koje se međusobno privlače. Hvala za uzajamna privlačnostčestice čvrste materije ne raspadaju se na pojedinačne molekule.
Ali molekuli ne samo da privlače, već i odbijaju. Ove sile, na primjer, ometaju kompresiju tijela. Pokušajte stisnuti gumenu gumicu. šta si dobio? Zašto misliš? Bilo je prilično teško stisnuti gumicu, jer to sprečava odbijanje molekula. Sile međumolekularne interakcije (privlačenja i odbijanja) stalno opažamo. Na primjer, kako se spajaju kapi kiše. Ako pritisnete dvije pažljivo polirane metalne ploče, bit će ih teško odvojiti jednu od druge. Ali nemoguće je ponovo spojiti pocijepan list papira duž linije kidanja, jer je rub papira vrlo tanak i neravan. Međutim, velike hrpe papira, ako su dugo vremena pohranjeni, tada će listovi takvog papira biti teško odvojiti jedan od drugog. To znači da se privlačnost manifestira na vrlo malim udaljenostima između čestica. Na udaljenosti od milionitog dijela milimetra, privlačnost između molekula praktički nestaje. Na još manjim udaljenostima javlja se odbojnost. Bez primjene sile na tijela, privlačenje i odbijanje između molekula njihovih supstanci su uravnoteženi.
Dakle, čestice materije međusobno djeluju, privlače i odbijaju.
Zanimljiva činjenica.Ne samo da molekuli iste supstance međusobno djeluju. Zahvaljujući ovoj interakciji, možemo lijepiti, variti i farbati. Kamen stavljen u vodu postaje mokar jer je privlačnost između molekula vode i kamena jača od privlačenja između molekula kamena i međusobno. Ali vosak se ne vlaži vodom. Voštani premaz na listovima sprečava vodu da poplavi stomate, a disanje biljaka nije ometano.
Agregatna stanja materije.
Materija se u zemaljskim uslovima javlja u tri stanja: tečnom, čvrstom i gasovitom. To vrlo dobro znate na primjeru vode. Vodena para, led i tečna voda su različite države iste supstance. Sigurno ste dobro upoznati sa ugljičnim dioksidom koji se oslobađa pri disanju i sagorijevanju, i sigurno su svi vidjeli suhi led kod prodavača sladoleda, ali ne znaju svi da je to čvrsti ugljični dioksid. Kiseonik u normalnim uslovima- gas, a kada se jako ohladi, postaje tečan, a zatim stvrdnjava. To znači da svaka supstanca, pod određenim uslovima, može biti tečna, čvrsta i gasovita, dok se hemijski sastav supstance ne menja. Takva stanja se nazivaju agregatna stanja materije .
Šta mislite kako će se različita stanja materije razlikovati ako njihov hemijski sastav ostane nepromijenjen? Naravno, rasporedom, interakcijom i kretanjem molekula. Čvrste tvari su obično kristalne. Na primjer: kvarc, dijamant, kuhinjska so, metali, pahulje, koje su kristali leda. Svi imaju pravilan oblik.
Molekuli u takvim tijelima nalaze se blizu jedan drugom u strogom redoslijedu, čvrsto drže na mjestu, „trče na mjestu“, samo povremeno skaču i mijenjaju svoj položaj. To objašnjava činjenicu da čvrsta tijela zadržavaju svoj oblik i volumen. IN normalnim uslovima teško ih je komprimirati ili rastegnuti, savijati ili trgati.
Kao što znate, kako temperatura raste, kretanje molekula postaje brže, "skakanje" na drugo mjesto je sve češće, a udaljenost između molekula se povećava. Interakcija između molekula slabi, supstanca postaje tečna. Ovo objašnjava osnovna svojstva tečnosti: slabo su kompresibilne, fluidne, zadržavaju zapreminu, ali lako menjaju oblik.
Ako se tečnost ostavi otvorena, postepeno će ispariti. To se događa jer će supstanca prelaziti iz jednog stanja (tečno) u drugo - plinovito. U gasovima, molekuli se nalaze "veoma daleko" jedan od drugog (u poređenju sa njihov sopstvene dimenzije ). Stoga slabo djeluju i kreću se u bilo kojem smjeru neograničeno daleko jedan od drugog. Iz tog razloga, plinovi ne zadržavaju svoj oblik i volumen, mogu se beskonačno širiti i lako se komprimirati.
Molekuli u supstanciji međusobno djeluju: privlače ili odbijaju. Sile međumolekularne interakcije pojavljuju se na vrlo malim udaljenostima između čestica tvari. Međusobni raspored, interakcija i priroda kretanja molekula određuju fizičko stanje supstance.
Agregatno stanje materije * Sile međumolekularne interakcije: privlačenje i odbijanje.
Testirajte svoje znanje
1. Navedite sile međumolekularne interakcije. Navedite primjere ovih sila.
2. Stavite malo naduvan balon ispod zvona vazdušne pumpe. Ako ispumpate vazduh ispod zvona, lopta će se naduvati. Zašto?
3. Na kojim udaljenostima se javljaju sile međumolekulske interakcije?
4. Objasni zašto čvrsta tijela dobro zadržavaju svoj oblik i volumen?
5.U kojim stanjima može biti supstanca? Navedite primjere.
6. Koja stanja materije se nazivaju agregatnim stanjima?
7. Objasnite zašto tečnosti imaju nisku stišljivost i ne zadržavaju svoj oblik?
8. Objasni zašto gasovi ne zadržavaju svoj oblik i zapreminu i lako se sabijaju?
With. 1
§ 07-g. Interakcija čestica supstanci
U prethodna dva paragrafa raspravljali smo o eksperimentima koji ilustruju prvu i drugu odredbu MKT. Razmotrimo sada eksperimente koji ilustruju treću glavnu poziciju MCT-a i njegove posljedice.
Za eksperiment uzmimo dva olovna cilindra sa kukama. Za uklanjanje čestica prašine, nožem ili oštricom očistite krajeve oba cilindra dok ne zasjaju (slika a). Čvrsto pritisnuvši krajeve jedan na drugi, otkrit ćemo da su cilindri čvrsto "zakočeni". Snaga njihovog prianjanja je tolika da ako se eksperiment izvede uspješno, cilindri mogu izdržati težinu utega do 5 kg (slika b). Zaključak koji se može izvući iz ovog iskustva je: čestice tvari se privlače jedna drugoj. Međutim, ova privlačnost je uočljiva samo kada su površine tijela vrlo glatke i, štoviše, čvrsto prislonjene jedna uz drugu.
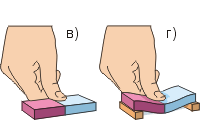
Uradimo drugi eksperiment (sl. c, d). Potrebno je mnogo sile da se prstom stisne gumena gumica; Lakše je saviti gumicu nego je stisnuti. Ostala tijela (osim gasovitih) je također vrlo teško komprimirati. Ovo sugerira da Čestice tvari se međusobno odbijaju.
Privlačenje i odbijanje čestica supstanci nastaju samo ako su čestice u neposrednoj blizini jedna drugoj. po pravilu, na udaljenostima velike veličine same čestice privlače; na udaljenosti manjim od veličine čestica, odbijaju se. Ako su čestice razdvojene na udaljenosti koja je mnogo puta veća od njihove veličine, interakcija se jedva pojavljuje.
Hajde sada da razmotrimo energetski aspekt interakcije čestica.

Ako bilo koja tijela interaguju, to jesu potencijalna energija, u zavisnosti od relativnog položaja ovih tela (videti § 5-d). Na slici desno, strelice na česticama pokazuju odbojne sile "susjeda". Sile gravitacije se takođe mogu prikazati na isti način. Kada bi sve čestice bile na jednakoj udaljenosti jedna od druge, tada bi sve sile bile međusobno uravnotežene ("zelena" čestica). Međutim, prema drugoj poziciji MCT-a, čestice se kreću. Stoga se udaljenosti od svake čestice do njenih susjeda stalno mijenjaju („crvena“ čestica). Posljedično, sile njihove interakcije se stalno mijenjaju i nisu uravnotežene. Sa ovim promjenama u udaljenostima i silama potencijalna energija svake čestice se mijenja, uzimajući minimalnu vrijednost u njenom ravnotežnom položaju.
Potencijalna energija čestice smatra se nulom kada se nalazi na velikoj udaljenosti od drugih čestica, kao što je, na primjer, u gasovima, gdje praktično nema interakcije između čestica (vidi sliku § 7-b). U čvrstim i tekućim supstancama postoji interakcija između čestica, što znači da postoji i potencijalna energija čestica (u zagradi napominjemo: negativna je, ali nas sada zanima njena apsolutna vrijednost). A da bi se prevazišla interakcija čestica i razdvojila, potrebno je raditi. I, što je veći rad na prevazilaženju interakcije čestica kako bi se razdvojili na udaljenosti, veća je (u apsolutnoj vrijednosti) potencijalna energija interakcije između čestica supstance koja se proučava.

Pojava elastične sile. Stiskanjem ili istezanjem, savijanjem ili uvrtanjem tijela približavamo njegove čestice ili ih uklanjamo (vidi sliku). Zato mijenjaju se sile privlačenja i odbijanja čestica čije se zajedničko djelovanje manifestira kao elastična sila.
Vratimo se na krivinu gumice (slika d). Konvencionalno smo gumene čestice prikazali kao kuglice. Prilikom pritiska prstom, gornje čestice se približavaju jedna drugoj („zelena“ udaljenost je manja od „crvena“). To dovodi do pojave između njih odbojne sile(crne strelice pokazuju dalje od čestica). Donje čestice se udaljavaju jedna od druge, što dovodi do pojave između njih sile privlačenja(crne strelice pokazuju prema česticama). Kao rezultat toga, gumica ima tendenciju da se ispravi, što znači da u njoj postoji elastična sila usmjerena prema gore - suprotno pritisku prsta.
Javascript je onemogućen u vašem pretraživaču.Da biste izvršili proračune, morate omogućiti ActiveX kontrole!





